阜外医院冯芳(遵循临床研究伦理原则,应注意三个方面)
(1)任何研究操作开展前,需要获得受试者自愿签署的知情同意书。
(3)研究期间发生受试者安全性的问题需要及时对受试者进行治疗。
(4)研究期间发生的严重不良事件,方案违背,研究进展报告,安全性报告等需要及时总结并报告伦理委员会,以便伦理委员会对已批准的研究项目进行定期跟踪审查,确保研究不会将受试者置于不合理的风险之中。
(4)任何受试者使用的文件均需伦理审查。
1 遵循伦理原则的基本要求
2 伦理审查的资料准备
(3)提前收集伦理委员会审查时需参考的文件
转载:请标明“中国循环杂志”
(1) 重视研究方案的撰写:研究是否具有科学和社会价值,并有相应的科学文献做支持。研究设计是否能回答研究问题,评价指标是否合理。受试者的纳入和排除标准是否恰当、公平。样本量的计算及其统计学依据是否合理,是否能用最小的样本量说明研究需要解决的问题。
(5)重视文件的规范性。
阜外医院冯芳教授是一位临床研究者,十多年来参与了十多项国际大规模多中心临床研究的运行管理及合规性管理,她作为阜外医院伦理委员会的秘书,直接参与伦理委员会的管理工作,切身体会到临床研究中需要注意以下三方面的伦理问题。
不同类型的临床试验会对项目负责人的资格有不同的要求。
冯芳教授建议研究者遵循法规及伦理委员会的要求,注意如下几个方面:
(2) 重视知情同意书的撰写:做到语言通俗易懂,以受试者能够理解的语言文字表达,无需照搬研究方案。内容含有必要、完整的信息,能达到充分告知的目的。
3 研究运行过程中需关注的伦理问题
在伦理审查中,风险受益比是伦理委员会重点关注的问题。
来源:冯芳.如何遵循临床研究伦理原则. 中国循环杂志,2019,34:1127.
任何在人体开展的研究除了考虑研究的科学性,还需遵循伦理原则,在保障受试者权益、安全性和健康的前提下方能开展临床研究。因此临床研究均需接受伦理审查。
研究者在学术期刊发表涉及人的生物医学研究成果的项目时,均应出具该研究项目经过伦理审查批准的证明文件。
(2)研究过程中信息发生了更改,如研究方案、知情同意书等进行了更新,需要再次获得伦理批准后方可使用。
每日两个西红柿,或三个苹果,或有助挽救吸烟“熏坏”的肺
近期一项对欧美人群追踪10年的研究显示,每日平均吃两个以上西红柿或者三个以上水果,尤其是苹果,有助于让吸烟“熏坏”的肺愈合。据研究者介绍,一个人通常在30岁时肺功能开始以不同速度衰退。而研究显示,每日平均吃两个以上西红柿或者三个以上水果,要比每天进食不到1个西红柿或1份水果,会更延缓肺功能的下降,尤其是之前有吸烟史的人中更为明显。 杨进刚阜外2023-08-13 14:16:510002
杨进刚阜外2023-08-13 14:16:510002中年油腻有新证据!高润霖院士等中国高血压调查44万余人新分析
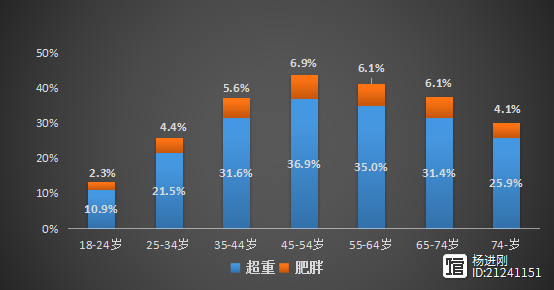
人到中年,身材走样,往往被形容是“中年油腻”邋遢样。为什么是中年,而不是老年?中国高血压调查研究最新分析结果表明,45~54岁人超重和肥胖的比例是18~24的年轻人的3.83倍。18~24岁的年轻人,10.9%超重,2.3%肥胖;而在45~54岁的中年人,36.9%人超重,6.9%肥胖。(见下图)图1不同年龄段人群超重和肥胖比例 杨进刚阜外2023-09-05 10:46:230000
杨进刚阜外2023-09-05 10:46:230000使用ECMO的患者,医生判断可以出院者仅占44%!中国体外生命支持医疗质控报告
体外膜肺氧合(ECMO)是体外生命支持技术的一种,近几年在国内取得较大发展,但面临问题较多。国家心血管病医疗质量控制中心专家委员会体外循环与体外生命支持专家工作组分析了2020年医院质量监测系统(HQMS)和全国医疗质量数据抽样调查系统(NCIS)使用了ECMO支持的患者,发布了医疗质量控制报告。 杨进刚阜外2023-10-01 22:14:070000
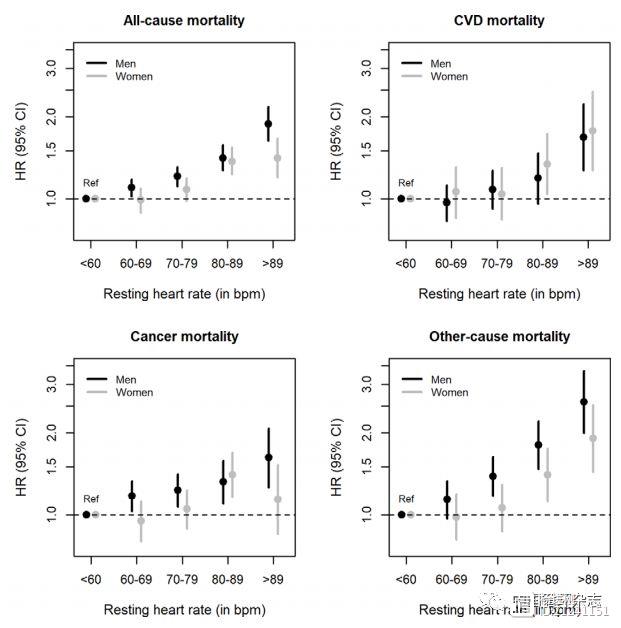
杨进刚阜外2023-10-01 22:14:070000Heart研究:心率每增加10 次/分,心血管死亡风险增加11%
Heart上发表的一项研究显示,静息心率快及十年内静息心率增加则死亡风险高。研究发现,静息心率每增加10次/分,心血管疾病、癌症和其他原因死亡率分别增加11%、10%和20%。图1静息心率与全因死亡及某些原因死亡风险而且,在10年期间,与静息心率稳定者相比,静息心率增加>15次/分(男性)或>25次/分(女性)者死亡风险更高。 杨进刚阜外2023-08-17 11:56:470000
杨进刚阜外2023-08-17 11:56:470000急性冠脉综合征抗血小板降阶治疗安全吗?阜外医院杨跃进等Meta分析
对于确诊急性冠脉综合征的患者,通常推荐进行双重抗血小板药物(阿司匹林P2Y12抑制剂)治疗。新型P2Y12抑制剂替格瑞洛和普拉格雷与传统的P2Y12抑制剂氯吡格雷相比能够有效降低缺血事件,但出血风险增加。