中国心脏大会2019举办发布会:强调多方参与,打造创新、服务和开放的合作平台
2018年10月10日上午,中国心脏大会(CHC)2019暨第四届中国血管大会(CVC)发布会在北京国宾酒店举办。

中国心脏大会学术委员会主席、国家心血管病中心副主任、中国医学科学院阜外医院副院长郑哲教授指出,中国心脏大会已连续举办十五届,规模、水平和学术影响均不断提升,既是专家学者的高端学术交流平台,也是产学研的展示平台,他希望媒体和企业等多方合作伙伴献计献策,为健康中国贡献力量。
大会常务副秘书长徐波教授介绍,中国心脏大会2019将于2019年9月19~22日在国家会议中心召开,由国家心血管病中心、《中国循环杂志》社、北京楷祺心血管公益基金会联合主办。
大会副秘书长、阜外医院心内科管委会主任唐熠达教授强调,中国心脏大会希望企业、媒体从“支持和参加”转变到“参与”这个角色,提供更多新技术和新设备展示、培训以及发布循证医学研究结果的机会。
大会副秘书长、《中国循环杂志》社编辑部主任杨进刚介绍,15年以来,中国心脏大会始终坚强调以“健康为中心,加强对慢病整体防控,强调预测、预防、个体化和人群的积极参与”。大会的参会人数也逐年增加,由最初2000多人增至2018年超过11000人,共有1563个会议报告,9场热点峰会、60个分论坛、18场手术转播、26场卫星会。
据悉,2019年中国心脏大会的主题是“新时代、心征程—创新 · 转化 · 合作”,更加着力推进高品质的临床实践,鼓励对创新理念、疗法及技术的探索。与以往相比,2019年的中国心脏大会涵盖的学术领域将更加宽泛,交流形式更加多样,预计将有200个学术专场。
在“创新驱动发展、建设健康中国”的今天,中国心脏大会不但成为我国心血管疾病防治学术交流的重要舞台,也为国内外同行带来了更多合作的机会。
欢迎购买《GAP-CCBC精彩病例荟萃2018》
“很多疑难复杂病例,一个医生一生也只能见到一次。”而《GAP-CCBC精彩病例荟萃2018》就是这样一本书。
0001
相关推荐
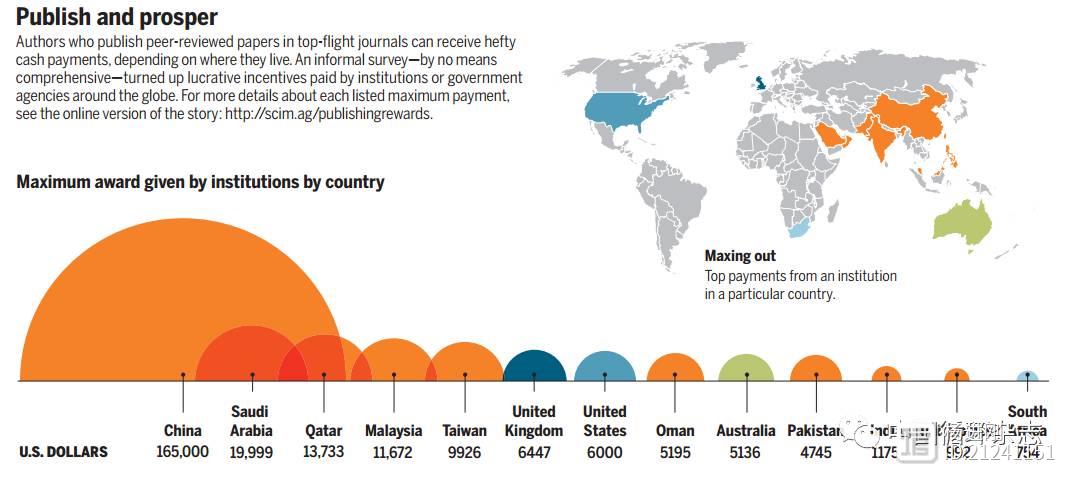
Science杂志:发高分文章,中国、沙特和卡塔尔学者得到奖励最多
Science杂志公布一项调查发现,多数国家的科研人员在高影响因子期刊上发表文章都会有奖励,中国、沙特阿拉伯和卡塔尔的科研人员能够得到的最高奖励位居前三。排在后面的是马来西亚、台湾、英国和美国。台湾最高可奖励近1万美元,美国6000美元。不同国家或地区科研机构奖励给论文发表者的最大奖励金额 杨进刚阜外2023-08-11 09:05:140000
杨进刚阜外2023-08-11 09:05:140000JACC子刊研究:咖啡和茶还可预防心律失常?
一直以来都认为咖啡因会影响心律,临床医生也通常会建议心律失常患者避免摄入咖啡因,但是澳大利亚学者在JACC子刊发表研究称,饮用含有咖啡因的咖啡和茶可减少心律失常发生,每天饮用三杯咖啡是安全的。为了明确咖啡、茶和能量饮料与心脏节律紊乱的关系,研究者对有关咖啡因对房性和室性心律失常的影响的研究进行了汇总分析。研究者发现,大量的研究显示那些经常规律饮用中等水平咖啡或茶的人发生心律失常的风险较低。病从口入!中国疾病负担报告:不健康饮食最影响国人健康,高血压和吸烟分列二、三位
李时珍说,饮食者,人之命脉。很多病都是吃出来的。1990~2016年中国及省级行政区疾病负担报告显示【点击下载全文】:包括高盐饮食、蔬菜水果摄入不足等在内的饮食风险因素是影响我国人群健康最主要的危险因素。研究显示,2016年,我国代谢、环境和行为三大类危险因素导致的标化伤残调整寿命年(DALY)损失达15562.9万人年,占总DALY数的44.8%。 杨进刚阜外2023-08-26 12:18:480000
杨进刚阜外2023-08-26 12:18:480000阜外蒋雄京等研究称,溶栓辅助介入治疗下肢动脉闭塞安全有效
阜外医院蒋雄京、陈阳等研究提示,置管溶栓辅助腔内成形治疗合并急慢性血栓的下肢动脉闭塞安全、有效,并可显著减少病变部位支架的使用,远期下肢血管通畅率高。研究者采用的置管溶栓治疗方法:若下肢动脉造影显示病变部位大量血栓影,则将导管插入血栓中,给予尿激酶(UK)行导管内溶栓治疗。