#清风计划# 一文搞定夏季宝宝常见皮肤问题
# 你好,夏至 #
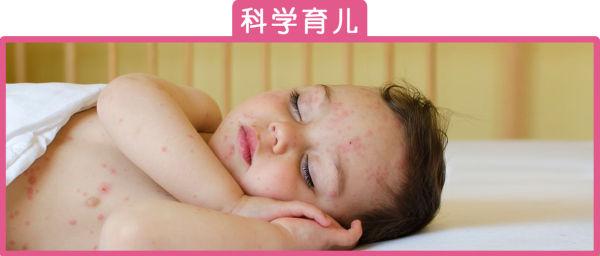
冬天孩子容易发烧和咳嗽,春天容易得流感和过敏。夏天,是各种皮肤问题袭扰孩子的高峰期。
今天 Dr.X 就给大家解读一下夏季孩子最常见的皮肤问题:
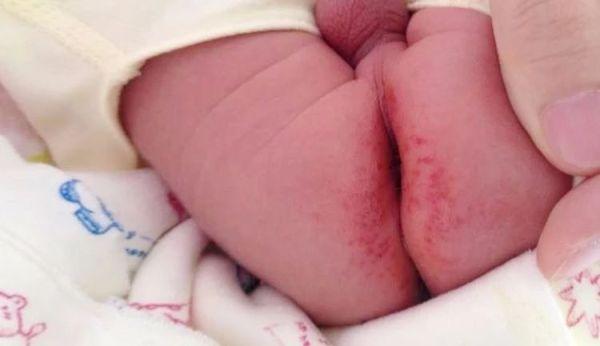
一、尿布疹
又名尿布皮炎,是夏季常见的皮肤问题之一。
夏季闷热潮湿,如果孩子的尿布比较厚或者较硬,又没有及时换,加上反复摩擦,就会引起尿布疹。而且,没有及时更换的尿布还会使细菌、念珠菌(真菌的一种)增殖速度加快,从而加重症状。
单纯的尿布疹皮肤损害局限于尿布区域,可见大片红斑、丘疹或糜烂渗液,一般不会累及臀缝和腹股沟,这是因为此处并不会接触到尿布。
家长怎么办?
轻度的尿布疹一般都不需要用药,通过正常的家庭护理,宝宝就可以自愈:
? 每天让宝宝至少光屁股3次,每次10分钟。
? 在给宝宝换新尿布前,涂抹一些含有氧化锌的护臀膏。
? 不要使用爽身粉!美国儿科学会明确禁止婴幼儿使用任何种类的爽身粉,因为它们可能被宝宝吸入到呼吸道,导致严重的肺部并发症。
最重要的是家长不能懒!要保持患处皮肤干燥、清洁,勤换尿布。在宝宝大小便后应用温水将臀部洗净,并用细软布轻柔擦干。
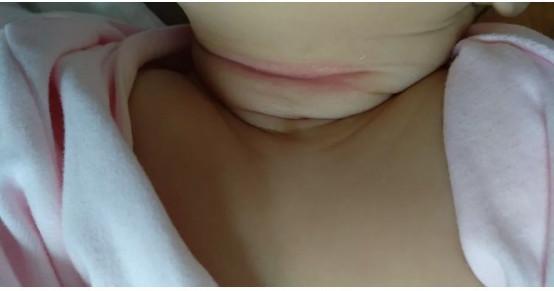
二、淹脖子(间擦疹)
由于皮肤褶皱处易潮湿、积汗、相互摩擦,引起局部皮肤充血的皮肤急性炎症,如颈前、耳后、腋窝、腹股沟、肛门附近等。出现在容易摩擦的部位,边缘界限清楚。
严重时可出现细菌或真菌感染,多见于新生儿及肥胖的婴儿。
家长怎么办?
? 给宝宝喂奶时,使用纯棉的口水巾,防止奶水流到脖子里。
? 每天及时用温水清洁褶皱部位,并轻柔擦干,保持局部干燥。
? 注意控制家里的温度和湿度,别给宝宝穿太多,以后颈温热为宜。
? 红肿严重的可以外用一些含激素或抗感染的药膏,如派瑞松软膏,帮助消炎消肿。
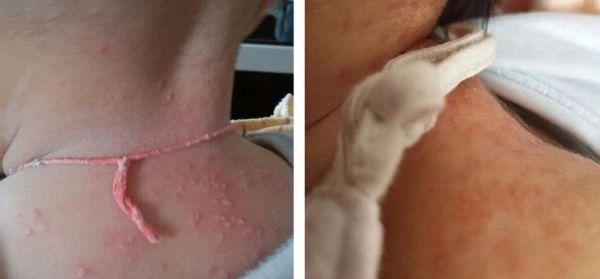
三、痱子
痱子的出现有两个原因:出汗过多,汗腺堵塞。
怎样判断是痱子还是湿疹?
? 痱子——点状。分散分布、极痒并伴有刺痛或麻刺感的红色小丘疹或丘疱疹。通常发生在间接摩擦的部位,如肘前窝、腘窝、躯干、腹部和腹股沟。多发于夏季,一般发病比较急。
? 湿疹——红色片状。一年四季都可以发生,常常对称分布,伴有黄白色的鳞屑及痂皮。皮肤干燥和食物过敏是湿疹的诱因,严重时需要应用激素类药膏进行治疗。
家长怎么办?
? 降 温。别担心宝宝吹风扇或吹空调会生病,该用就得用。可以将空调温度控制在26~28℃,出风口不要对着宝宝直吹,风扇也不要一直对着宝宝吹,就ok了。
? 清 洁。很多宝宝出痱子都是捂出来的,保持卧室通风,穿宽松透气的衣服,宝宝出汗后及时洗个温水澡,或者进行温水擦浴。
? 干 燥。宝宝新陈代谢的速度要快于成人,因此生成汗液的速度也比大人要快。大量出汗很容易堵塞毛孔,从而生成痱子。
再次强调,不要给宝宝用任何痱子粉或爽身粉!!! 不仅不利于宝宝排汗,还可能吸入粉尘造成肺部并发症!
四、蚊子包
首先一定是做好防护,但是谁也不能绝对避免蚊虫叮咬,婴幼儿免疫系统不成熟,通常会刺激身体分泌组胺来抵抗,因此「包」会比成人更大,更明显,那么应该如何处理蚊虫叮咬呢?
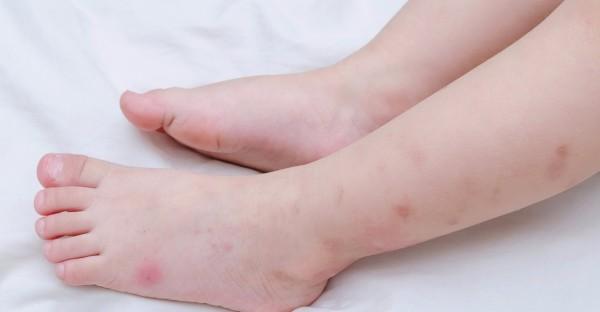
家长怎么办?
? 蚊子叮咬后的包,一般会自然消失,宝宝没有不舒服的可以不做处理。
? 避免宝宝抓挠,可以用一条凉的湿毛巾冷敷来减轻瘙痒感,也可以用炉甘石洗液清洗被叮咬处,注意避免接触孩子的眼部和生殖器部位。
? 如果红肿持续不退,可使用外用的抗过敏药(如赛庚啶软膏),或低浓度的糖皮质激素软膏(如丁酸氢化可的松软膏等)进行治疗。
五、晒伤
夏天对宝宝皮肤问题最直接的伤害就是日晒,在日光下长时间曝晒会导致皮肤发红、脱皮、起疱,也可能会导致日光性皮炎、多形性日光疹、荨麻疹等皮肤病的发生。
除了皮肤炎症,还可能出现远期伤害,比如说产生色素沉淀,形成褪不去的色素斑。
有研究认为,至少90%的皮肤癌都是阳光造成的,其中大多数可以避免。在婴儿期或儿童期受到一次严重晒伤,癌症风险提高1倍。

家长怎么办?
? 宝宝6个月以前,物理防晒。要避免接受阳光直射,外出时使用必要的防晒用具,比如防晒衣、防晒帽、太阳镜、推车阳蓬、遮阳伞等。
? 宝宝6个月大之后,可以使用防晒霜。因为婴儿的皮肤屏障还没发育成熟,建议购买专用的儿童防晒霜(只含有二氧化钛或氧化锌的物理防晒品)。
六、摩擦性苔藓样疹(儿童丘疹性皮炎)
与玩沙子、接触植物(如草地)、玩水、在粗糙的地毯上爬行等有关,或是睡粗糙的被褥及衣边的摩擦而发病。
常见于易受到摩擦和刺激的部位,如手背、前臂伸侧,有时可见于指节、肘、膝或大腿等部位。
针头至粟粒大小丘疹,淡红色或正常皮肤颜色,可呈轻度苔藓样,有时可见轻度脱屑,无水疱及渗出。皮损多对称,但分布疏密不均。一般为肤色,且无自觉症状或仅轻度瘙痒。
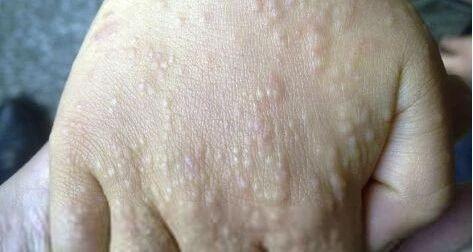
家长怎么办?
? 这种病一般4~8周就能自愈,不需要特别的治疗。家长只需让宝宝减少与粗糙刺激物的接触就可以。

Dr.X说:
宝宝夏天皮肤问题,防大于治。
家长必须做到保持宝宝皮肤干燥又减少水分的流失,在家控制好室内温度和湿度,出外减少在阳光下暴晒的时间。
相信在妈妈的正确护理下,宝宝的娇嫩皮肤会一直保持良好的状态。

如果夫妻活过了75岁,还能做到这3件事,就是人生赢家
有这样一个问题:“为什么很多老夫妻,一个人离世后,另一个活不了多久?”显然,这个问题,有以偏概全的嫌疑。毕竟,有的夫妻,走了一个之后,另一个人可以活二三十年。但是问题是客观存在的,主要是因为夫妻相依为命多年,若是有人先走一步,后走的人,在思想、生活上失去了依靠,也会常常陷入思念的痛苦。 布衣粗食682023-08-10 16:59:480000
布衣粗食682023-08-10 16:59:480000老年人越懒越健康?要做到以下5种懒,一起来看看是哪5种?
健康长寿一直是人们关注的话题,尤其是人到了老年,退休了,接下来的生活就是要健康、快乐的生活,对健康饮食、健康生活方式更加关心。而生活中,通常老年人为了体现自己的价值,不服老,总是非常的勤快,这对身体健康是很不利的。人到了一定的年纪,想要健康长寿,就要学着“懒”一些,这里的“懒”具体指的是什么呢?我们一起来了解一下。老年人越懒越健康?要做到以下5种懒,一起来看看是哪5种?1、懒得生气 老张话健康2023-11-14 11:08:050000
老张话健康2023-11-14 11:08:050000寿命短的女人,往往都有这三个特征,别不信,并非迷信
寿命是每个人都关心的话题,尤其是女性。有人说,寿命短的女人往往都有一些共同的特征,这并非迷信,而是通过科学研究得出的结论。今天我们将探讨这三个特征,并解释为什么它们与寿命有关。第一个特征是身体健康状况寿命短的女人往往身体健康状况较差。这可能是由于遗传因素、生活方式或环境因素等多种原因导致的。例如,一些女性可能患有慢性疾病,如心脏病、糖尿病或癌症,这些疾病会严重影响寿命。 健康八条2023-08-05 11:31:590000
健康八条2023-08-05 11:31:590000女性长时间没有夫妻生活,对身体有啥危害?
据调查数据显示,有将近30%的成年女性都在遭受长期没有夫妻生活的困扰。有些是因为长期单身,而有些是因为夫妻长期分居,甚至有些即使天天在一起,也没有一个正常的夫妻生活。事实上,长时间没有夫妻生活,让很多女性都苦不堪言。不仅仅是因为生理需求得不到满足,更重要的是她们担心会影响自己的身体健康。那么,长时间没有夫妻生活,对女性到底有没有危害呢?成年女性正常的夫妻生活频率应该是多少?

 e药安全
e药安全

 养生与益寿
养生与益寿
 蔓萝花
蔓萝花